Periyodik tablo içerisinde bilinen bütün elementlerin isimleri ve artan atom sayılarına göre derecelendirilmiştir. Periyodik tablodan öncesinde konu ile ilgili araştırmalar yapılmış, icadın isim sahibi ise Rus kimyager Dimitri Mendeleyev olarak kabul görmektedir. 1869 yılında Mendelev, tablo ve atomların artan atom ağırlıklarına uyacak şekilde derecelendirildiğinde, belirli özelliklerinin yinelenebiliyor oluşundan ortaya çıkartmıştır. Mendeleyev ile birlikte Julius Lothar Meyer’in de bu çalışmalarda adı geçmektedir. Alman bir bilim insanı olan Meyer, aynı Mendeleyev gibi periyodik tablo ile ilgili detaylı araştırmalar yapmıştır. Peki, tam olarak periyodik tablo nedir ve ne işe yarar?
Periyodik Tablonun Oluşturulma Süreci

Periyodik tablo ile ilgili merak edilen konulardan biri nasıl oluşturulduğudur. Elementlerin sınıflandırılması ve aralarındaki benzerliklerin fark edilmesi, alanla ilgilenenlerde merak uyandırmıştır. Peki, periyodik tablo nasıl oluşturulmuş ve kim tarafından oluşturulmuştur?
Periyodik tablonun bulunması ile ilgili iki kişinin ismi geçmektedir. Bu kişiler; Alman bilim insanı Julius Lothar Meyer ve Rus bilim insanı Dimitri Meddeleyev’dir. Bu isimler birbirlerinden habersiz benzer çalışmalar yürüterek periyodik tablo oluşumuna katkıda bulunmuşlardır.
Mendeleyev, elementlerin atom ağırlıklarının artmasına bağlı olarak elementleri sıralamıştır. Bu sıralama sonucunda elementlerin belli özelliklerinin tekrarlandığını görmüştür. Daha sonra bu elementleri tekrarlanan özelliklere göre alt alta sıralamıştır. Yaptığı bu sıralamada ise ilk iki periyodu yedi, sonraki üç periyodu on yedi element bulunacak şekilde bir sistemle sıralamıştır. Rus bilim insanı hazırladığı periyodik sistemde bazı yerleri boş bırakmıştır. Çünkü kendisi hala keşfedilmemiş elementler olduğunu düşünmektedir. Bu nedenle elementler bulundukça tabloda uygun yerlere yerleştirileceğini düşünmüştür. Düşündüğü gibi de olmuştur. Sonraki süreçte bulunan germanyum, galyum ve skandiyum elementleri tabloda uygun yerlere yerleştirilmiştir.
1895 yılında Lord Rayleigh, yeni bir soygaz (argon) keşfetmiştir. Bu element tabloda uygun bir yere yerleştirilmek istenmiş ancak başarılamamıştır. 1898 yılında William Ramsay soygaz elementinin klor ile potasyum arasında bir yere konulması düşüncesini belirtmiştir. Bu düşünce kabul edilmiş, daha sonra helyum da bu gruba dahil edilmiştir. Bu grup, elementlerin değerliklerinin sıfır olması nedeniyle sıfır grubu adını almıştır.
Hazırlanan bu tablo elementlerin periyodik niteliklerini göstermektedir. Fakat neden özelliklerin tekrarlandığı konusunda aydınlatıcı bir bilgi içermemektedir.
Periyodik Tablo Nedir?
Aşağıda olan görselde de gözüktüğü üzere, dünya da bilinen bütün kimyasal elementler içerisine eklenmiştir. Burada bulunan elementler bir araya getirilerek de farklı deneyler yapılmaktadır.
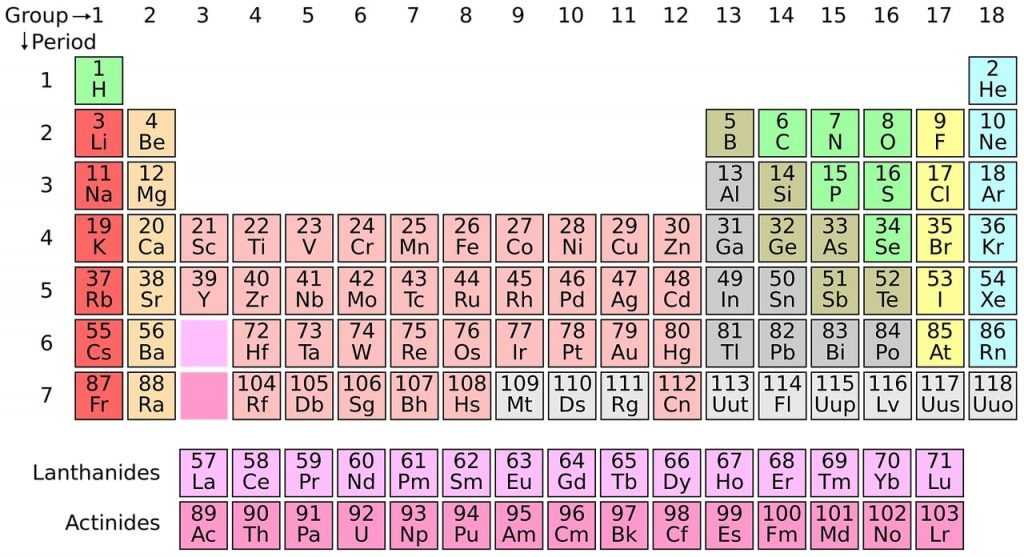
Periyodik tabloda aynı sütunda yer alan elementlerin dizilimdeki son elektron sayıları aynıdır. Bu elementler benzer diziliş konfigürasyonuna sahiptir.
Periyodik Tablo Okuma
Periyodik tabloya bakarak elementlerin sahip olduğu birçok özelliğe ulaşılabilmektedir. Elementlerin gruplanmalarındaki kriterleri bilmek, tabloyu buna göre incelemek bu alanla ilgilenenler için büyük kolaylık sağlamaktadır. Bu tablonun oluşturulmasında dikkat edilen kriter ise şunlardır; atom numarası, atom ağırlığı, atom sembolü ve kütle numarasıdır.
Atom Numarası
Elementlerin atom numarasını, sahip oldukları proton sayısı belirlemektedir. Proton sayısı, elementlerin bir nevi tanımlamasıdır. Elementlerin kimliğini oluşturmaktadır. Atom numarası belirlenen bir elementin kimyasal davranışı da belirlenebilir duruma gelmektedir.
Atom Ağırlığı
Bir elementin atomlarının ortalama kütlesinin, atomik kütle birimindeki elemente olan oranı şeklinde tanımlanmaktadır. Bir elementin ortalama nötron sayısı atom ağırlığından yararlanılarak bulunabilmektedir. Bunun için elementin atom kütlesinden proton sayısının çıkarılması gerekmektedir.
Atom Sembolü
Bir elementi temsil eden kısaltmaya atom sembolü denir. Elementler tek ya da iki harfle belirtilerek kolayca tanımlanmaları sağlanmaktadır. Kullanılan bu semboller uluslararası olarak kullanılmaktadır. Bu sembollere örnek verecek olursak; Tungstenin sembolü “W”, altının sembolü ise “Au” şeklindedir.
Kütle Numarası
Kütle numarası, bir elementin proton ve nötronlarının toplamını tanımlamaktadır. Çekirdekteki proton ve nötron toplamını yansıtan bu numara elementin sol üst kısmına yazılmaktadır.
Periyodik Cetvel Grupları
Dış yüzeyi elektron olarak dizilen ve benzer olan elementlerin bir araya getirildiği haline denir. Gruplar periyodik cetveldeki sütunlardır. Bir grup içerisinde olan elementlerin, kimyasal özellikleri de aynıdır.
Ayrıca grupları iki farklı şekilde isimlendirilir. İlk grup; IUPAC’in tavsiyesi ile 1’den 18’e kadar ki kısmında olan sayıları kapsar. İkinci grup ise; Tekrarı daha çok mümkün olan harf olan A ve B ya da rakamlardan bir araya gelecek şekilde isimlendirilir.
Periyodik Cetvel Periyotları
Periyodik cetvel içerisinde yer alan satırların her birine periyot denir. Toplamında yedi adet periyot bulunmaktadır. Altıncı periyotun toplam element sayısı 32 olduğu için, fazlalık olan 14 element aşağı da yer alan gruba eklenmiştir. Fazlalık olan gruba ise lantanit denmektedir. Benzer şekilde yedinci periyottan da ayrılan bölümler bulunmaktadır, bunlara da aktinit denmektedir.
Periyodik Cetvel Blokları
Hidrojen ve helyum dışında olan elementler, değerlik orbitallerine göre sıralandığında; s, p, d ve f ile birlikte 4 farklı blok içerisinde ayrılmaktadır. s, p ana grup; d, f ise yan grup olarak nitelendirilmektedir.
Periyodik Tablo İçerisinde Olan Düzenli Değişimler

Periyodik tablo içerisinde soldan sağa ya da yukarıdan aşağı gidildiği taktirde sürekli olan değişiklikler gözlemlemek mümkündür. Bunlardan bazıları ise atom yarıçapı, iyonlaşma enerjisi ve elektronegatifliktir.
Periyodik tabloda inceleme yaparken, elementlerde gerçekleşen değişimlere hakim olmak oldukça önemlidir. Bu sayede belli kriterlere göre aranan bir elementi bulmak oldukça kolaylaşmaktadır. Ayrıca bir elementin sahip olduğu atom çapı, iyonlaşma enerjisi gibi birçok faktör kolayca saptanabilmektedir. Elementler arasında karşılaştırmalar yapılmak istendiğinde, sahip olunan bu hakimiyet çalışmaları oldukça hızlandırmaktadır. Periyodik tabloda hangi yöne gidildikçe ne gibi değişikler olduğu şöyle sıralanabilir;
Belirlenen Periyotta Soldan Sağa Gidilmesi Durumunda
- Atom numarası, proton sayısı artmaktadır.
- Atom kütlesi, nötron sayısı, kütle numarası artmaktadır.
- Atom çapı küçülmektedir.
- İyonlaşma enerjisi artmaktadır.
- Elementlerin sahip olduğu metal özelliği azalmaktadır. Ametal özelliği artmaktadır. (8A buna dahil değildir.)
- Elementin elektronegatifliği artmaktadır. (8A buna dahil değildir.)
- Elementlerin yükseltgen özelliği artmaktadır. (8A buna dahil değildir)
- Elementlerin hidroksitlerinin ve oksitlerinin baz özelliği azalmaktadır. Asidik özelliği artmaktadır. (8A buna dahil değildir.)
Belirlenen Grupta Yukarıdan Aşağıya Gidilmesi Durumunda
- Proton sayısı, elektron sayısı, çekirdek yükü, kütle numarası artmaktadır.
- Elementin atom çapı büyümektedir.
- İyonlaşma enerjisi ve elektronegatiflik azalmaktadır.
- Değerlik elektron sayısı sahip kalmaktadır.
- Elementlerin sahip olduğu metal özelliği artmaktadır. Ametal özelliği azalmaktadır.
- Elementlerin hidroksitlerinin ve oksitlerinin baz özelliği artmaktadır. Asit özelliği ise azalma göstermektedir.
- Elementlerin yükseltgen özelliği azalırken, indirgen özelliği artmaktadır.

